Les traigo la explicación detallada de como la proteina espicular S trímera del SARS-COV-2 se acolpa a los receptores de membrana ACE2 de la célula huesped para infectarla.
Primero se logró la estructura 3D de la glicoproteína espicular S del coronavirus SARS-CoV-2 y su dominio de unión al receptor RBD (
LCMF, 24 Feb 2020). Luego la del receptor de la célula huésped, la enzima convertidora de angiotensina humana hACE2 (
LCMF, 07 Mar 2020). El siguiente paso era determinar la del complejo SARS-CoV-2 RBD/hACE2. Se publican dos artículos en
Nature que la obtienen por cristalografía de rayos X, alcanzando sendas resoluciones de 2.45 Å y 2.68 Å. Cambios estructurales muy sutiles explican la mayor infectividad y patogénesis de SARS-CoV-2 (COVID-19) comparado con SARS-CoV (SARS); un par de puentes salinos y un puente de hidrógeno conducen a una unión más fuerte entre la cresta de los motivos de unión al receptor (RBM) de la proteína espicular del coronavirus y una hélice N-terminal de hACE2 en la membrana de la célula huésped. Sin lugar a dudas, lo que estamos aprendiendo sobre este coronavirus es muy relevante para el desarrollo de fármacos que combatan la COVID-19 y vacunas que controlen futuros rebrotes de la epidemia.
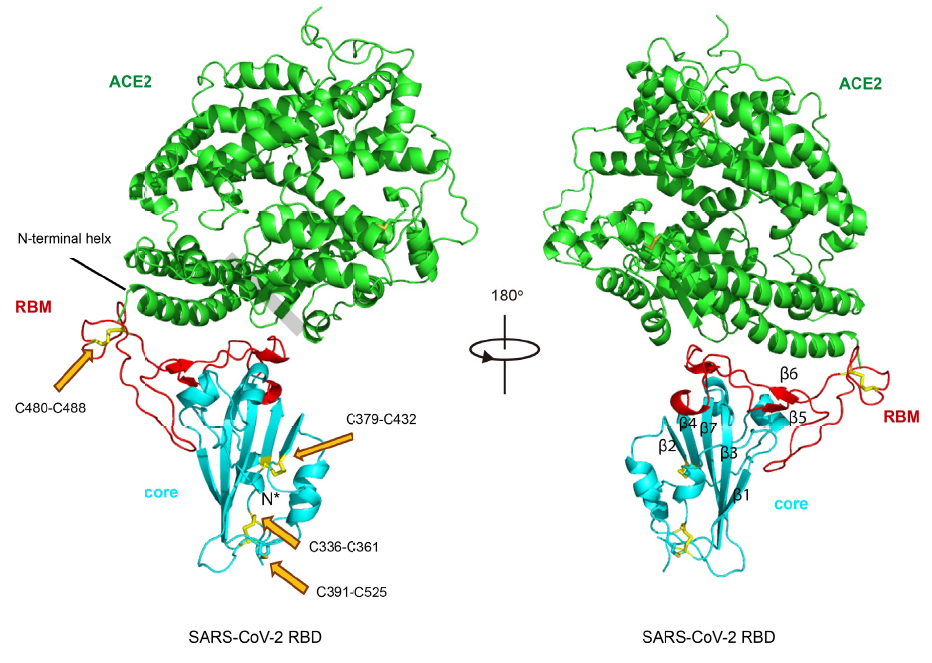
Los incautos pueden pensar que conocidas las estructuras de RBD y hACE2 inferir cómo se unen entre sí debe ser trivial (como juntar piezas de LEGO). Pero por desgracia la bioquímica estructural no es (un juego de niños) tan fácil. Se han realizado reconstrucciones
in silico (mediante modelos teóricos usando ordenadores), pero la observación de la estructura cristalográfica real mediante difracción de rayos X es imprescindible. Por supuesto, el primer problema es como formar el complejo SARS-CoV-2 RBD/hACE2 con suficiente estabilidad para su observación; sin entrar en detalles, la experiencia previa en la formación del complejo SARS-CoV RBD/hACE2 (que se logró en 2005) ha sido clave (se aprovecha un puente salino entre Arg426 de RBD y Glu329 de hACE2 para reforzar la unión del complejo). En la figura se muestra en color rojo el RBM, en celeste el RBD y en verde hACE2; en amarillo, apuntados con flechas en naranja, se destacan los enlaces disulfuro; Cys336-Cys361, Cys379-Cys432 y Cys391-Cys525 estabilizan las cinco hojas beta (β1, β2, β3, β4 y β7), y Cys480-Cys488 es clave en la unión entre el la cresta del SARS-CoV-2 RBM y la hélice N-terminal de hACE2.
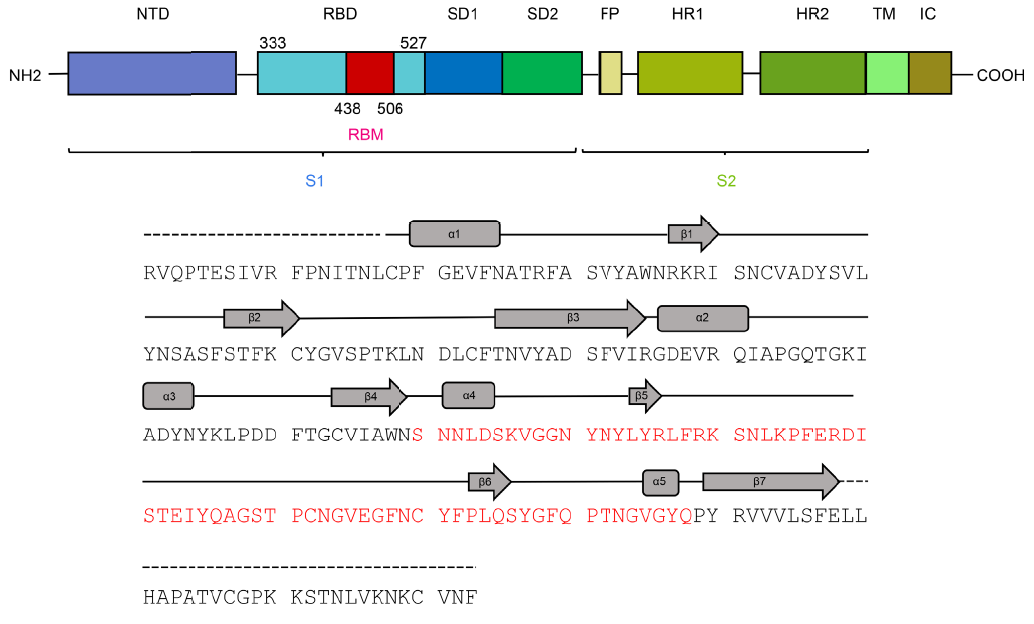
Esta figura muestra la estructrura primaria (secuencia de aminoácidos) del monómero de la proteína espicular S de SARS-CoV-2. El dominio terminal N (NTD) antecede al dominio de unión con el receptor (RBD) que incluye el motivo de unión con el receptor (RBM). Tras los subdominios SD1 y SD2, y el péptido de fusión (FP), aparecen las dos regiones de héptadas repetidas, HR1 y HR2. Finaliza la región transmembrana (TM) y el dominio intracelular (IC). Más detalles en mi pieza «La estructura 3D de la glicoproteína espicular del coronavirus SARS-CoV-2»,
LCMF, 24 feb 2020.
La comparación entre los complejos SARS-CoV RBD/hACE2 y SARS-CoV-2 RBD/hACE2 permite entender por qué es más infectiva COVID-19 que SARS. La SARS-CoV-2 RBM forma un interfaz de unión más grande y con más contacto con hACE2 que SARS-CoV RBM; una de las razones es que el puente salino entre SARS-CoV RBD y hACE2 es más débil que el de SARS-CoV-2 RBD y hACE2, pero más favorable energéticamente. Además, la estructura cristalina del complejo también contiene glicanos acoplados a los cuatro sitios de hACE2 y el sitio de RBD. El glicano acoplado a Asn90 de hACE2 forma un enlace he hidrógeno con Arg408 del núcleo de RBD; esta interacción se conserva entre SARS-CoV-2 y SARS-CoV.
Las diferencias estructurales entre las RBMs de SARS-CoV-2 y SARSCoV RBMs son sutiles, pero afectan a las conformaciones de los lazos en las crestas de unión al receptor (
receptor-binding ridge en la figura). En ambas RBMs, uno de los lazos de la cresta contiene un enlace disulfuro que es crítico en la unión. SARS-CoV y bat-CoV Rs3367 contienen un motivo con tres residuos Pro-Pro-Ala en dicho lazo; pero en SARS-CoV-2 y bat-CoV RaTG13 muestran un motivo de cuatro residuos Gly-Val/Gln-Glu/Thr-Gly; así la conformación del bucle cambia gracias a que las glicinas son más flexibles. Este cambio favorece la unión RBD/hACE2. Además, la creta tiene una conformación más compacta gracias a los puentes de hidrógeno Asn487 y Ala475 en SARS-CoV-2 RBM, con lo que el lazo que contiene Ala475 se coloca más cerca de hACE2.
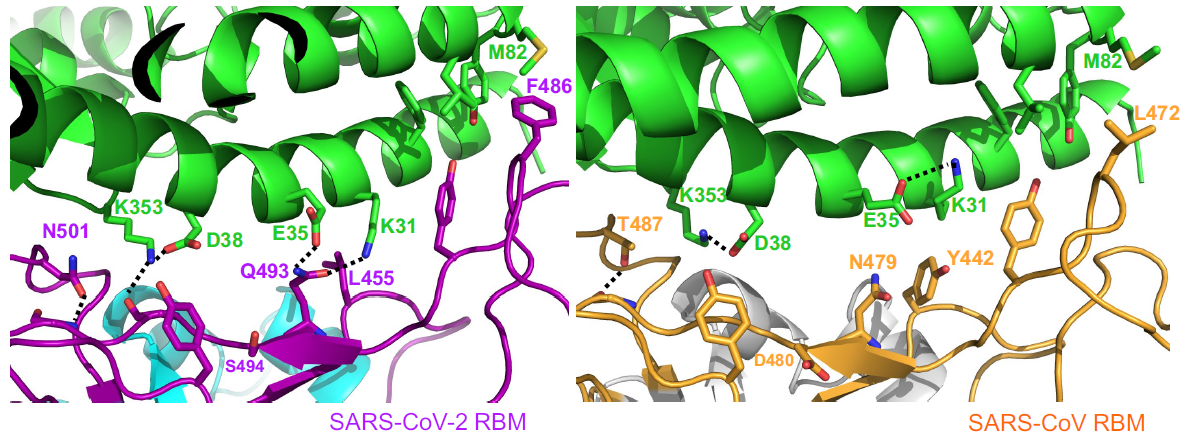
El contacto de la cresta de SARS-CoV-2 RBM con la hélice N-terminal de hACE2 es mayor que para SARS-CoV RBM. Por ejemplo, el residuo N-terminal Ser19 de hACE2 forma un nuevo enlace de hidrógeno con la cadena principal de Ala475 de SARS-CoV-2 RBM, y la Gln24 de la hélice N-terminal de hACE2 también forma un nuevo contacto con SARS-CoV-2 RBM. Al compararla con la Leu472 del SARS-CoV RBM, la Phe486 de SARS-CoV-2 RBM apunta en una dirección diferente y forma una región hidrófuga que involucra a Met82, Leu79, y Tyr83 de hACE2.
La comparación con SARS-CoV RBM muestra que estos pequeños cambios estructurales de SARS-CoV-2 RBM son más favorables para la unión con hACE2. Son diferencias sutiles, pero muy relevantes desde el punto de vista funcional. Se han desvelado dos puntos críticos de unión (
virus-binding hotspots), el punto crítico hotspot-31 en el puente salino Lys31 y Glu35, y el hotspot-353 en otro puente salino entre Lys353 y Asp38. Estos dos puentes salinos son débiles, debido a la gran distancia en la interacción, pero como están encerrados en un entorno hidrófugo, que reduce la constante dieléctrica efectiva, su energía de enlace es mayor. Los artículos en
Nature discuten este punto con bastante detalle (recomiendo a los lectores interesados una lectura detallada de los mismos).
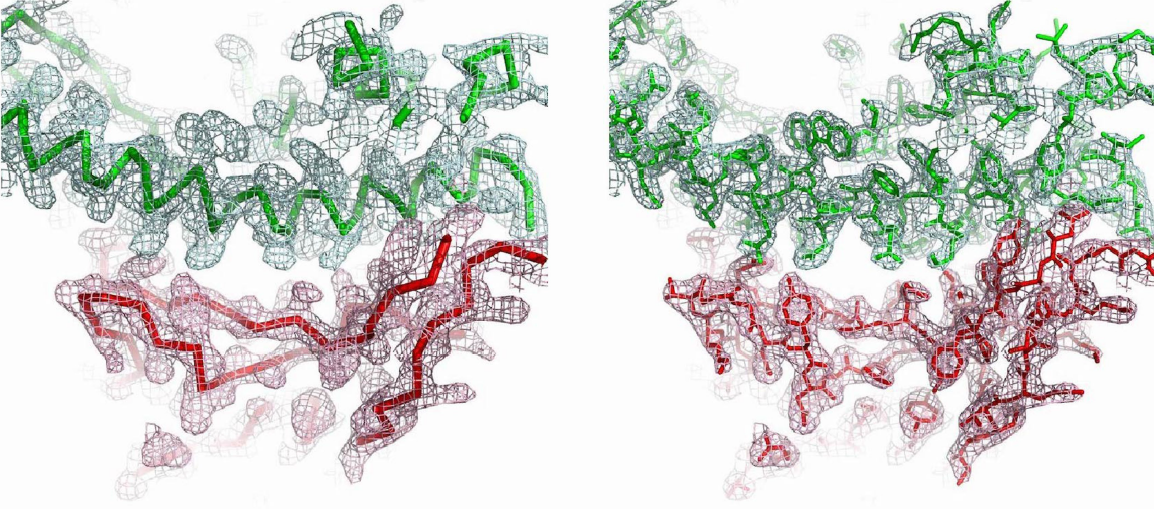
Esta figura muestra la densidad electrónica de la unión entre SARS-CoV-2 RBD (rojo) y hACE2 (verde). Las estructura del complejo permite desvelar por qué SARS-CoV-2 reconoce a hACE2 mucho mejor que SARSCoV. La cresta de unión de SARS-CoV-2 RBM es más compacta y forma mejor contacto con la hélice N-terminal de hACE2 gracias a cambios estructurales debidos al motivo de cuatro residuos (residuos 482-485: Gly-Val-Glu-Gly). Además, la Phe486 de SARS-CoV-2 RBM se inserta en una región hidrófuga, mientras la leucina correspondiente en SARS-CoV RBM forma un contacto más débil con hACE2 al tener una cadena lateral más pequeña. Más aún, los dos puntos críticos de unión (hotspots) son más estables al contener dos residuos de lisina acomodados en un ambiente hidrófugo que neutraliza sus cargas; los residuos Gln493 y Leu455 estabilizan el hotspot-31, mientras que Asn501 estabiliza el hotspot-353.

Para confirmar estas conclusiones estructurales se han realizado estudios bioquímicos para la afinidad de la unión RBD/hACE2 tras introducir ciertas mutaciones en SARS-CoV-2 RBD. No entraré en los detalles, pero destacaré que sugieren que el coronavirus de murciélagos RaTG13 podría infectar a los humanos (lo que ratifica el origen zoonótico de la epidemia). Además, las RBMs de SARS-CoV-2 y bat-COV RaTG13 contienen un motivo similar de cuatro residuos en la cresta de unión a ACE2, lo que apoya que uno ha evolucionado a partir del otro. Más aún, para mejorar el reconocimiento de hACE2, SARS-CoV-2 presenta dos cambios en los residuos L486F e Y493Q de RaTG13, que parece que han facilitado la transmisión de SARS-CoV-2 desde el murciélago a los humanos. Así, podría no haber un huésped intermedio entre el murciélago y el humano en la COVID-19, a diferencia de lo que ocurrió con SARS y con MERS. Por supuesto, por ahora es imposible descartar la existencia de un mediador, que bien podría ser un pangolín u otro animal salvaje vendido en el mercado de Wuhan; en el caso del pangolín es necesario secuenciar más genomas de coronavirus de pangolín para dilucidar la cuestión (algo que no están entre las prioridades de los científicos chinos ahora mismo).
En resumen, la ciencia sobre la infección COVID-19 y el coronavirus SARS-CoV-2 están avanzando a un ritmo asombroso. Los resultados que se están obteniendo son fascinantes. Y tendrán implicaciones clínicas en menos de un año. En un par de meses hemos logrado lo que costó varios años hace dos décadas. Y todo gracias a la ciencia básica. Porque lo que aprendes de una infección, como SARS o como MERS, que ya ni siquiera recordamos, acaba siendo de importancia capital en una nueva infección, como COVID-19. Esta pandemia nos recuerda que gastar en ciencia básica no solo es necesario, es imprescindible.













 ) conocer distintos lugares, de ser posible, viajaba harto y chillan era de las pocas ciudades que siempre que pasaba o recorria sus alrededores, era como ....ñeee.... hay algo para hacer o conocer (naturaleza, pueblos, etc) en chillan o en los alrededores?
) conocer distintos lugares, de ser posible, viajaba harto y chillan era de las pocas ciudades que siempre que pasaba o recorria sus alrededores, era como ....ñeee.... hay algo para hacer o conocer (naturaleza, pueblos, etc) en chillan o en los alrededores?

 Quieren comida
Quieren comida







) conocer distintos lugares, de ser posible, viajaba harto y chillan era de las pocas ciudades que siempre que pasaba o recorria sus alrededores, era como ....ñeee.... hay algo para hacer o conocer (naturaleza, pueblos, etc) en chillan o en los alrededores?